2025年成考高起点每日一练《理化综合》3月23日专为备考2025年理化综合考生准备,帮助考生通过每日坚持练习,逐步提升考试成绩。
单选题
1、由两种物质组成的固体混合物,放入水中有白色沉淀生成,加入过量稀HNO3,沉淀消失并有气泡产生,再加入AgNO3溶液,又有白色沉淀生成。该组物质是()。
- A:Na2CO3和Al(OH)3
- B:K3PO4和CaCl2
- C:MgCl2和K2CO3
- D:K2SO4和BaCl2
答 案:C
解 析: (2)“再加入AgNO3溶液,又有白色沉淀生成。”首先在此之前已加入过量稀HNO3,所以再加AgNO3溶液又有白色沉淀生成,这说明原混合物中应含有Cl-。所以A选项被排除,只有C选项符合要求。 C选项中的MgCl2与K2CO3反应,生成的KCl留在溶液中,所以加入AgNO3发生如下反应:
(2)“再加入AgNO3溶液,又有白色沉淀生成。”首先在此之前已加入过量稀HNO3,所以再加AgNO3溶液又有白色沉淀生成,这说明原混合物中应含有Cl-。所以A选项被排除,只有C选项符合要求。 C选项中的MgCl2与K2CO3反应,生成的KCl留在溶液中,所以加入AgNO3发生如下反应:
2、下列物质中不能由金属单质与非金属单质直接反应制得的是()。
- A:FeS
- B:Cu2S
- C:FeCl2
- D:CuCl2
答 案:C
解 析:常见的变价金属Fe和Cu直接与非金属单质反应时,因非金属的氧化性强弱不同,生成不同价态的铁和铜的化合物。如:Fe和Cu与非金属性(即氧化性)很强的Cl2反应,生成铁和铜的高价氯化物(严格地说应是在Cl2过量的条件下)。 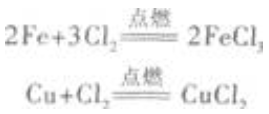 但Fe和Cu与非金属性不很强的S单质反应时,则生成低价铁和铜的硫化物。
但Fe和Cu与非金属性不很强的S单质反应时,则生成低价铁和铜的硫化物。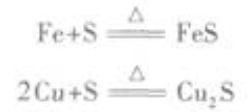
多选题
1、某溶液中有NH4+、Mg2+、Al3+、Fe2+等4种离子, 若向其中加入过量的 NaOH溶液, 微热并搅拌, 再加入过量的盐酸, 溶液中大量减少的阳离子是
- A:NH4+
- B:Mg2+
- C:Fe2+
- D:Al3+
答 案:AC
主观题
1、工业上用焙烧NaHCO3的方法生产纯碱(Na2CO3)。现有17.5g的NaHCO3样品,加热分解完全后,生成标准状况下的CO2气体2.24L。写出NaHCO3分解反应的化学方程式,计算此NaHCO3样品的纯度。
答 案:NaHCO3分解反应的化学方程式如下: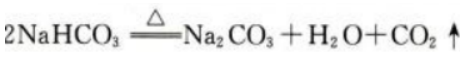 反应生成标准状况下的CO2气体2.24L,其物质的量为0.1mol,故加热完全分解的NaHCO3的物质的量为0.2mol,质量为16.8g,此NaHCO3样品的质量为17.5g,所以此NaHCO3样品的纯度为16.8g/17.5g×100%=96%。
反应生成标准状况下的CO2气体2.24L,其物质的量为0.1mol,故加热完全分解的NaHCO3的物质的量为0.2mol,质量为16.8g,此NaHCO3样品的质量为17.5g,所以此NaHCO3样品的纯度为16.8g/17.5g×100%=96%。
2、如图,一质量为m1的木块静置在光滑的水平面上,一质量为m2的子弹以速度v0水平射入木块,进入木块s距离后相对木块静止。设子弹相对木块静止前受到的阻力恒定。求从子弹开始进入到相对木块静止这段时间内
(1)子弹与木块组成的系统损失的机械能。
(2)木块移动的距离。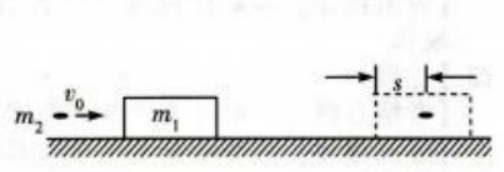
答 案:(1)根据动量守恒定律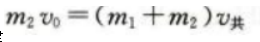 根据功能关系
根据功能关系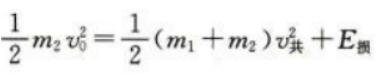
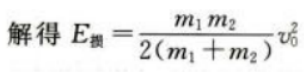 (2)设子弹与木块间摩擦力为f,则E损=fs设物块运动距离为L,对物块运用动能定理
(2)设子弹与木块间摩擦力为f,则E损=fs设物块运动距离为L,对物块运用动能定理
填空题
1、FeCl3溶液中先通入过量的SO2,再滴加BaCl2溶液,产生的白色沉淀为()(填化学式),说明SO,具有()性。
答 案:BaSO₄;还原
解 析:本题考查了二氧化硫的性质的知识点。 二氧化硫具有还原性,能与氧化铁发生氧化还原反应生成硫酸根,可用氯化钡检验生成的硫酸根。
2、如图5—15所示,用一条细绳通过一个光滑的滑轮将一个0.20kg的砝码和光滑桌面上的一个0.80kg的小车连接在一起。开始时用手握住小车使砝码离开地面1.0m,然后放手使小车从静止开始运动。试计算: 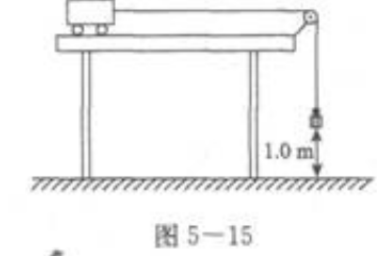 (1)开始时砝码的重力势能(g取10m/s2)。 (2)放手后砝码到达地面时小车的速度(桌面足够长)。
(1)开始时砝码的重力势能(g取10m/s2)。 (2)放手后砝码到达地面时小车的速度(桌面足够长)。
答 案:2J,2m/s
简答题
1、某同学在做“测定电池的电动势和内阻”的实验时,把实验线路接成如图14—26所示的情况,线路是否正确?哪些地方有错误?请把它改正过来。
答 案:图14—26的线路不正确,错误的地方是:①照这样连接,滑动变阻器的滑片不起作用,应将A处的接线移到C处(或D处),也可将B处的接线移到D处(或C处)。②电压表的正接线柱接到了电池的负极上,标着“3”的接线柱接到了电池的正极上,极性接反了,可把电池倒过来,“+”接线柱与电池的正极相接,接线柱“3”,通过开关与电池的负极相接。③电流表的正接线柱虽然通过开关与电池的正极相接,但接线柱“3”通过滑动变阻器和开关也与电池的正极相接,可在按②改正过的线路上,把电流表正接线柱上的接线从电压表标着“3”的接线柱上改接到电压表的正接线柱上。改正过的线路如图14—27所示。 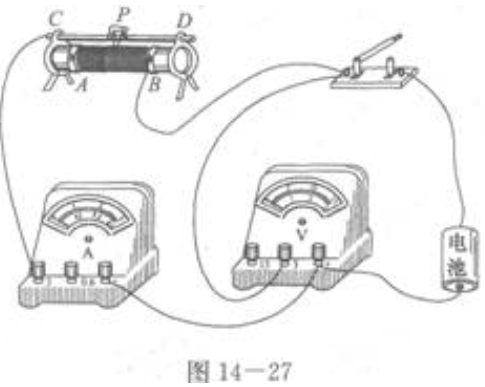
2、25℃时用铂电极电解118g CuSO4溶液,当CuSO4电解完全,得到100 mL密度为1.1g/cm3的无色溶液,试计算: (1)原CuSO4溶液的质量分数。
(2)电解后所得溶液中氢离子浓度。
答 案:
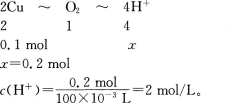
精彩评论